Las células estromales mesenquimales (MSCs, por sus siglas en inglés), comúnmente conocidas en español como células madre mesenquimales, han sido definidas por la Sociedad Internacional de Investigación de Células Madre (ISSCR) como células no hematopoyéticas de morfología similar a los fibroblastos. Cada vez despiertan mayor interés gracias a sus potentes capacidades regenerativas y de reparación tisular. Hasta el año 2015, la mayoría de los estudios clínicos con MSCs se centraban en el tratamiento de trastornos del sistema musculoesquelético, debido principalmente a su potencial de diferenciación en tejidos como hueso y cartílago. Sin embargo, más recientemente, ha cobrado fuerza el interés por sus propiedades inmunomoduladoras, demostradas en el tratamiento de enfermedades como la enfermedad injerto contra huésped (GVHD) y diversas patologías autoinmunes, incluyendo lupus eritematoso sistémico y enfermedad de Crohn. El potencial clínico de las MSCs también se ha ampliado a otras condiciones como el infarto de miocardio, el accidente cerebrovascular (ACV), la esclerosis múltiple, la cirrosis hepática, la diabetes mellitus y lesiones pulmonares, entre muchas otras.
Más allá de la célula: el poder del secretoma
Un número creciente de estudios sostiene que los efectos terapéuticos observados tras la administración de MSCs no se deben tanto a su integración o diferenciación celular, sino a estas acciones paracrinas. Esto se explica porque el número de células sobrevivientes tras el trasplante suele ser bajo, en comparación con el impacto observado en términos de inmunomodulación, efecto antiapoptótico, antifibrótico o angiogénico.
El entorno importa: cómo se modula el secretoma
La acción paracrina de las MSCs depende en gran medida del microambiente que las rodea. En condiciones in vitro, múltiples variables pueden modular su secretoma y, por tanto, su eficacia terapéutica. Entre ellas se incluyen: Composición del medio de cultivo Niveles de oxígeno (hipoxia) pH, temperatura Número de pasajes (en células expandidas) Cultivo en esferoides o sistemas 3D bioimpresos Estímulos mecánicos o electromagnéticos Estas condiciones no solo influyen en la cantidad y tipo de moléculas secretadas, sino también en su funcionalidad. Cuando el medio de cultivo se enriquece con el secretoma celular, se obtiene lo que se denomina medio condicionado.
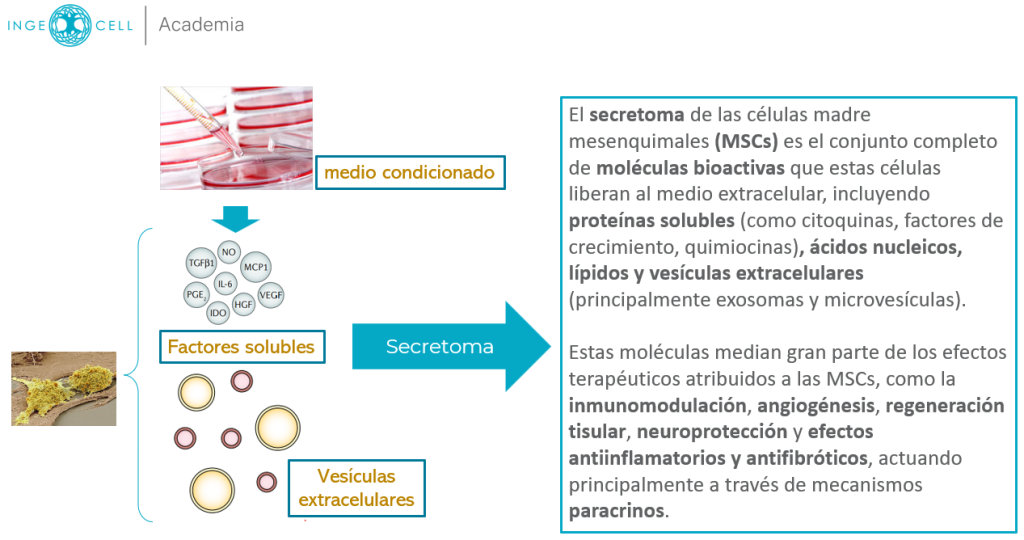
¿Qué contiene el medio condicionado?
El medio condicionado incluye:
- Factores solubles, como:
– Citoquinas: IL-6, IL-10, IL-7, MCP-1
– Factores de crecimiento: FGF, PDGF, HGF, TGF-β, VEGF, GM-CSF, LIF
– Moléculas inmunorreguladoras como SDF-1, TSG-6
2. Vesículas extracelulares (VEs):
– Exosomas: vesículas de origen endosómico, de 30 a 100 nm, que se forman dentro del citoplasma.
– Microvesículas: derivadas directamente de la membrana plasmática, con un tamaño entre 100 y 1000 nm.
Ambos tipos de vesículas actúan como transportadores de proteínas, lípidos y ácidos nucleicos, y participan activamente en la comunicación intercelular.
¿Qué ventajas ofrece el medio condicionado frente al uso directo de células?
Las terapias basadas en secretoma o medio condicionado ofrecen múltiples beneficios frente al trasplante celular directo:
- Mayor estabilidad del efecto terapéutico, ya que el secretoma actúa más allá del tiempo de vida de las células trasplantadas.
- Menor inmunogenicidad, dado que las vesículas extracelulares tienen baja expresión de antígenos de superficie, facilitando su uso en aplicaciones alogénicas.
- Reducción de la necesidad de grandes cantidades de células (hasta 7 x 10⁶ células/kg en trasplantes convencionales).
- Producción escalable y controlada en condiciones estandarizadas, como en biorreactores.
- Formato práctico y económico para uso clínico, evitando la recolección invasiva de células.
- Posibilidad de personalizar el secretoma según la patología, modulando las condiciones de cultivo.
- Mayor disponibilidad clínica, sin necesidad de expandir células por semanas antes del tratamiento.
- Evaluación farmacológica, ya que el secretoma puede analizarse en términos de dosis, bioseguridad y potencia terapéutica.
- Almacenamiento seguro, sin necesidad de crioprotectores tóxicos, manteniendo su actividad biológica.
Conclusión
El secretoma de las MSCs representa una plataforma terapéutica altamente prometedora, que puede adaptarse y estandarizarse según las necesidades clínicas. Su composición varía dependiendo del tipo celular, el origen del donante, las condiciones de cultivo y otros factores que deben ser rigurosamente controlados.
En INGECELL contamos con la experiencia, el equipo científico y la infraestructura para acompañarte en la implementación de estas terapias en tu práctica clínica o de investigación. Desde asesoría técnica hasta formación especializada, te ayudamos a ofrecer terapias avanzadas con criterio y respaldo científico.
📲 Puedes escribirnos por WhatsApp al +34611558570 o enviarnos un correo a info@ingecell.com.







