Hoy en día, la investigación con células madre es la columna vertebral de la medicina regenerativa. Las células madre tienen una gran variedad de posibilidades prometedoras. Algunas de las cuales ya nos hemos dado cuenta y otras, tan solo podemos soñarlas, por ahora.
Antes de entrar de lleno en entender que son las células madre mesenquimales, vale la pena conocer un poco más de la historia de cómo se ha alcanzado el conocimiento sobre estas.
Una pregunta válida que nos hacemos es quien las descubrió. Y en ese caso no se puede atribuir a un solo investigador, ya que de forma indirecta, desde el siglo IXX se especulaba de su existencia. En 1957, de forma empírica, E. Donnall Thomas realizó con éxito un trasplante de médula ósea, donde demostró que efectivamente existían unas células capaces de reconocer la médula ósea del huésped, donde alojarse y restituir la producción de las células de la sangre, fenómeno conocido como homing. Esto le valió un premio Nobel. A partir de ese momento, los trasplantes de médula ósea se convierten en un procedimiento estándar tanto para adultos como para niños. Este procedimiento se usa actualmente como una de las terapias más frecuentes en el tratamiento de diversos tipos de cáncer de la sangre, y muy recientemente se ha propuesto como un tratamiento para el HIV1.
Sin embargo, fue a los Dres. James Till y Ernset McCulloch, a quienes se les reconoce el haber demostrado de la existencia de estas células. El 2 de febrero de 1963 inician sus experimentos y publican un artículo que demostraba que las células sanguíneas maestras en ratones se diferenciaban en líneas distintas: eritrocítica, granulocítica y megacariocítica, demostrando finalmente su existencia.
¿Todas las células madre presentes en la médula ósea son iguales?
En realidad, en la médula ósea encontramos dos grandes líneas, las células madre hematopoyéticas, que permiten la producción de todas las células de la sangre y otro tipo de célula también multipotencial in vitro, que da origen a diversos tejidos especializado como son hueso, cartílago, músculo, adiposo, entre otros. Estas células fueron denominadas por la Sociedad Internacional de Terapia Celular y Genética (ISCT) como células estromales mesenquimales (MSC por su acrónimo en inglés).
El Dr. Arnold Caplan por su parte propone el término células madre mesenquimales, que lleva el mismo acrónimo, para referirse inicialmente a un tipo de células presente en el estroma de la médula ósea, las cuales han demostrado propiedades terapéuticas de gran interés, como es la inmunomodulación y sus funciones paracrinas, con alto potencial regenerativo.
Entonces, ¿Qué son las células madre mesenquimales (MSC)?

Históricamente al Dr. Arnold Caplan se le reconoce como el «Padre de las MSC» por su importante aporte en el descubrimiento de las características de las células madre mesenquimales, perfeccionando la tecnología para aislarlas y aprendiendo a hacerlas crecer de forma eficaz en cultivo.
Mientras la Sociedad Internacional de Terapia Celular y Genética (ISCT) emitió un documento para fijar posición en el 20062, aclarando que el término célula madre mesenquimal no es equivalente o intercambiable con célula estromal mesenquimal. El primero se refiere a una población de células madre con funcionalidad demostrable de células progenitoras de autorrenovación y diferenciación, mientras que el último se refiere a una población heterogénea con capacidad de secreción, inmunomoduladora, paracrina y propiedades de homing. Si bien la controversia persiste hasta nuestros días, lo que es aceptado, buscando unificar la calidad de estas células con fines terapéuticos es que deben cumplir con los criterios experimentales mínimos, que se describen en el cuadro 1.
Y para incrementar la confusión en ambos casos, bien sean células estromales mesenquimales (mesenchymal stromal cell), células madre mesenquimales (mesenchymal stem cell) o más recientemente células señalizadoras medicinales (medicinal signaling cell), utilizan el mismo acrónimo en inglés MSC, por lo cual se sigue manteniendo gran confusión entre la nomenclatura y el empleo terapéutico, incluso el manejo a nivel de la industria de la salud, en todo lo relacionado con estas células.
Clínicamente, las células madre mesenquimales (MSC) han cobrado gran interés por su capacidad para modular el sistema inmunológico, así como su potencial para regenerar tejidos. Comprender la identidad y función in vivo de estas células es vital para aprovechar al máximo su potencial terapéutico. Por ello, recientemente, están surgiendo nuevos datos que demuestran los roles no descritos previamente de las MSC in vivo.
Comprender el comportamiento de las MSC in vivo es fundamental, ya que los resultados recientes sugieren que estas funciones adicionales permiten que las MSC funcionen como células medicinales de señalización3.
En su carta, publicada en Nature5, el Dr. Caplan, en respuesta a un artículo bastante mordaz publicado por otros investigadores4 indica lo siguiente:
Estoy de acuerdo con Douglas Sipp y sus colegas en que las clínicas deberían dejar de usar la nomenclatura de «células madre mesenquimales» para comercializar terapias con células madre y de medicina regenerativa4. Pero no deberíamos descartar 25 años de datos y experiencia clínica simplemente porque acuñé erróneamente ese término para células perivasculares en 1991…
En 2010, le pedí a la industria de la terapia celular que cambiara el término células madre mesenquimales por células de señalización medicinal (MSC, acrónimo en inglés, en este caso de medicinal signaling cells). Esto se debió a que, aunque se puede inducir la diferenciación de las MSC en cultivo, no lo hacen in vivo. Sin embargo, incluso estas preparaciones heterogéneas de MSC muestran una funcionalidad terapéutica cuando se introducen en el cuerpo, lo que sugiere que tienen capacidad paracrina (es decir, medicinal) …
Los científicos eventualmente descubrirán cómo las preparaciones de MSC logran su efecto terapéutico, y las empresas pueden hacerlas más efectivas y menos costosas. También nos permitirá diseñar mejores protocolos de aislamiento, cultivo y presentación de pacientes.” Culmina diciendo Caplan en dicha carta5. Lo que resulta verdaderamente interesante es que efectivamente el termino “mesenchymal stem cell” y su traducción al español como células madre mesenquimales, sigue siendo un término “tenaz”, es decir quedó firmemente arraigado en la cultura médica, se puede ver la cantidad de artículos publicados en pocos años, utilizando dicha terminología, que aun hoy en día se mantiene, tal como se puede ver en la figura 1.

Dos años más tarde del inicio de esta importante polémica cientifica, en plena pandemia, se sigue acumulando evidencia de la capacidad de estas células de actuar como sistemas de “señalizadores medicinales”, ya que hasta la fecha estas células han demostrado ser uno de los tratamientos con mayor efecto terapéutico en los pacientes afectados por COVID-19, permitiendo rescatar a mas del 85% de los pacientes en condición de gravedad y en proceso post COVID, reduciendo los procesos degenerativos e inflamatorios de las secuelas que esta grave enfermedad acarrea.
Esta actividad de señalización medicinal se suma a la contribución de las MSC al mantenimiento del nicho de las células madre y la homeostasis. Cada vez hay más pruebas de que no todas las células descritas como MSC comparten las mismas propiedades. La mayoría de las MSC residen en una ubicación perivascular y tienen algunas funcionalidades en común con las de los pericitos y las células adventicias ubicadas alrededor de la microvasculatura y los vasos más grandes, respectivamente.
Debemos tener en cuenta que el uso de estas células madre mesenquimales en terapia celular presenta diversas limitaciones justamente por la alta heterogeneidad demostrada durante el aislamiento y cultivo. De allí la importancia de disponer de procesos de buenas practicas de laboratorio que mantengan altos estándares de control de calidad, que aseguren la reproducibilidad en la obtención y manejo de estas células.
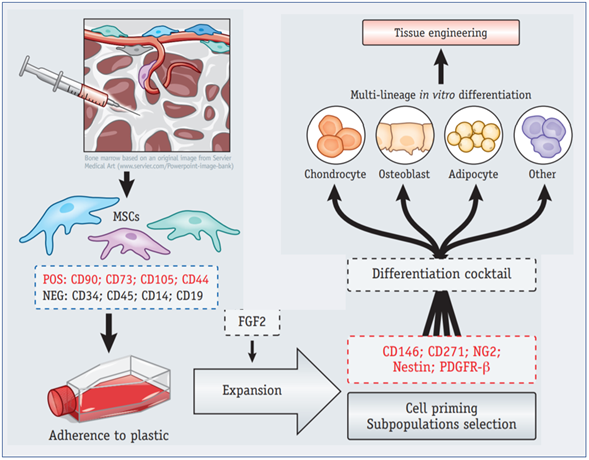
Las MSC se pueden aislar de la médula ósea y otros tejidos vascularizados. incluyendo grasa, pulpa dental y músculo. También se han aislado de los tejidos perinatales tales como placenta, cordón y líquido amniótico. En general, tal como detallamos antes se definen in vitro por un perfil de expresión de marcadores de superficie específico, su capacidad de adherirse al plástico y formar colonias (CFU-F), y su capacidad de expansión en serie. De una población inicial heterogénea, se pueden obtener subpoblaciones específicas, al emplear en el cultivo algunos factores de crecimiento específicos (por ejemplo, FGF2).
Para sus aplicaciones en ensayos clínicos, estás células deben ser procesadas en instalaciones certificadas y siguiendo procedimientos de buenas prácticas (GMP) y así garantizar que sean de grado clínico.
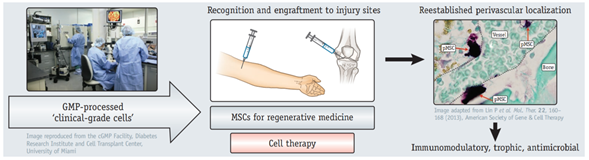
La disponibilidad y La versatilidad de estas células las convierten en una excelente opción para el tratamiento de amplia variedad de condiciones clínicas asociadas con inflamación, isquemia, autoinmunidad y trauma, gracias a que al ser suministradas de manera exógena, las MSC tienen la capacidad de migrar hasta los sitios de la lesión, en el caso de las MSC que originalmente derivan de los pericitos, regresan a localizarse a nivel perivascular y en estos sitios ejercen sus actividades inmunomoduladoras y tróficas locales6.
En INGECELL le brindamos toda la información y orientación que requiera para la implementación y uso de las terapias avanzadas. Contáctenos al WhatAapp +57 350 5310687 o nuestro email info@ingecell.com
Fuentes:
- Krishnan, A. (2009). Stem cell transplantation in HIV infected patients. Current Opinion in HIV and AIDS, 4(1), 11.
- Dominici, M. L. B. K., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F. C., Krause, D. S., … & Horwitz, E. M. (2006). Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 8(4), 315-317.
- Nature 566, 39 (2019) doi: https://doi.org/10.1038/d41586-019-00490-6
- D. Sipp, P. G. Robey & L. Turner (2018) Clear up this stem-cell mess Nature 561, 455-457. https://www.nature.com/articles/d41586-018-06756-9. Revisado el 05/11/2020
- Caplan, A.I. (2019) MSCs: They work, so use them. Nature, 566, 39, (Correspondence, February 7) https://media.nature.com/original/magazine-assets/d41586-019-00490-6/d41586-019-00490-6.pdf Revisado el 05/11/2020.
- Somoza, R. A., Correa, D., & Caplan, A. I. (2016). Roles for mesenchymal stem cells as medicinal signaling cells. Nat Protoc, 11(1).







